Medikamentöse Therapie des metastasierten Nierenzellkarzinoms (mRCC) – Update 2017
Aus der Abteilung Urologie (Leitender Arzt: Oberstarzt Dr. H. Heidenreich) des Bundeswehrkrankenhauses Berlin (Chefarzt: Admiralarzt Dr. K. Reuter)
Zusammenfassung
Die Einführung der targeted Therapie hat über die letzten 10 Jahre die Behandlung des metastasierten klarzelligen Nierenzellkarzinom (mRCC) revolutioniert. Aktuell konnten neue Substanzen erstmalig einen Vorteil im Gesamtüberleben aufzeigen, andere zeigen in der Kombinationstherapie vielversprechende Ansätze.
Diese Arbeit soll einen aktuellen Überblick über die derzeit verfügbaren Substanzen geben, ein Rational ihres Einsatzes im klinischen Alltag aufzeigen und anhand der Zulassungsstudien einen Einblick in Wirkmechanismus und Wirksamkeit sowie mögliche Einsätze in der Sequenztherapie diskutieren.
Schlüsselwörter: klarzelliges Nierenzellkarzinom, targeted drugs, Tyrosinkinaseinhibitoren, mTOR-Inhibitoren, Checkpoint-Inhibitoren, Sequenztherapie
Summary
The introduction of targeted therapies over the past 10 years lead to dramatical changes in treatment of metastatic clear cell renal cell carcinoma (mRCC). Recently, for several new agents improvement of overall survival could be demonstrated; other substances show promising effects in combination therapy. This review is to provide a topical summary of drugs available in a clinical setting, the rationale for their use and – by review of studies during approval procedures – insight in mechanisms of action and effectiveness. Also, an algorithm for sequential therapy is proposed.
Keywords: clear cell renal cell carcinoma, targeted drugs, tyrosine kinase inhibitors, mTOR inhibitors, checkpoint inhibitors, sequencing of treatment
Hintergrund
Das Nierenzellkarzinom (RCC) liegt mit einer Inzidenz von rund 15 000 Neuerkrankungen im Jahr 2013 in Deutschland an 7. Stelle der Krebsneuerkrankungen [22]. Bei Erstdiagnose sind bereits 25 - 30 % der Patienten metastasiert [7]. Dazu kommt ein Anteil von 20 - 30 % an Fällen, die nach Nephrektomie meist innerhalb der ersten 3 Jahre einen Relapse entwickeln [1].
Bei Männern verursacht der Nierenzellkrebs 2,6 % und bei Frauen 2,1 % aller Krebssterbefälle. Im Jahr 2010 waren dies 5 247 Menschen (3 096 Männer und 2 151 Frauen), die in Deutschland an einem malignen Nierentumor verstorben sind [22]. Trotz großer Fortschritte in den letzten 10 Jahren durch den Einsatz zielgerichteter Substanzen gegen vascular endothelial growth factor (VEGF) und mammalian target of rapamycin (mTOR) wird die Mehrzahl der betroffenen Patienten eine Resistenz gegen VEGF- und mTOR-gerichtete Therapeutika entwickeln. Neue Strategien sind notwendig, um Resistenzen zu überwinden und langanhaltende Remissionen zu erzielen.
Die urologischen Abteilungen der Bundeswehrkrankenhäuser (BwKrhs) verfügen nicht nur über die operative Expertise (Organerhalt, minimalinvasiver Zugang), sondern stellen sich zeitgemäß auch der Herausforderung dieser innovativen medikamentösen Tumortherapie.
Methodik
Die Evidenzsynthese erfolgte über PubMed mit dem Schlüsselwort „metastatic renal cell carcinoma“ unter besonderer Berücksichtigung von Reviews des aktuellen Jahres. Ausgeschlossen wurden u. a. nicht randomisierte Studien, Case Reports, Studien mit einem negativen Ergebnis sowie Artikel über Substanzen, die nach persönlicher Überprüfung kein positives Votum der EMA (European Medicines Agency) aufweisen. Einbezogen wurden die Leitlinien der EAU (European Association of Urology), der ESMO (European Society for Medical Oncology) sowie die deutsche S3-Leitlinie einschließlich der entsprechenden Literaturangaben.
Ergebnisse
Zugelassene Substanzen
Unter dem Suchbegriff „metastatic renal cell carcinoma“ fanden sich insgesamt 13 919 Treffer im Zeitraum von 1946 bis heute (Stand 12.04.2017). Es wurden 10 Studien identifiziert, die den Kriterien entsprachen und zur Zulassung der untersuchten Substanzen in Europa führten. Tabelle 1 zeigt die entsprechenden Ergebnisse. In den Leitlinien der EAU, ESMO und der deutschen S3-Leitinie fanden sich 396, 54 bzw. 703 Literaturstellen. Zudem wurde ein Review aus dem Jahre 2017 gefunden.
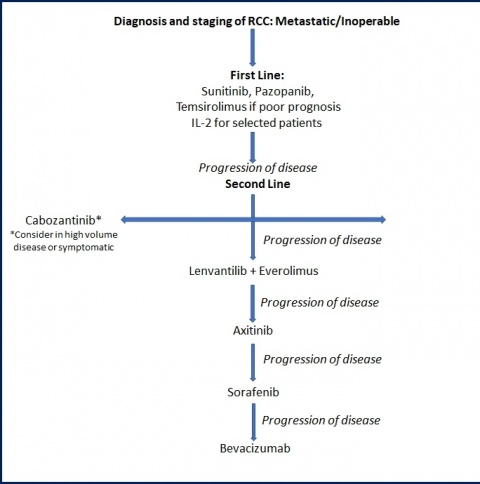
Die Tyrosinkinaseinhibitoren (TKI) Pazopanib [20] und Sunitinib [16], der mTOR-Inhibitor Temsirolimus [9] sowie der VEGF-Antikörper Bevacizumab in Kombination mit Interferon-α [3] besitzen die Zulassung in der Erstlinientherapie. Die Tyrosinkinaseinhibitoren Sorafenib [5], Axitinib [12], Cabozantinib [20] und Lenvatinib in Kombination mit Everolimus [11], der mTOR-Inhibitor Everolimus [15] und der Checkpointinhibitor Nivolumab [14, 21] sind in der Zweitlinientherapie zugelassen. In der Erstlinientherapie konnte lediglich Temsirolimus einen Vorteil bezüglich des Gesamtüberlebens zeigen, in der Zweitlinientherapie gilt dies für Cabozantinib und Nivolumab. Lenvatinib in Kombination mit Everolimus wurde von der EMA auf dem Boden einer Phase 2-Studie zugelassen.
Tab. 1: Zusammenfassung der Ergebnisse der Zulassungsstudien
| Substanz | Vergleich | PFS (Monate) | P-Wert | OAS (Monate) | P-Wert |
| Sunitinib | Interferon | 11 | <0,001 | 26,4 | 0,051 |
| Bevacizumab | Interferon | 10,2 | <0,0001 | 23,3 | 0,1291 |
| Temsirolimus | Interferon | 5,5 | 0,0001 | 10,9 | 0,0069 |
| Pazopanib | Placebo | 9,2 | <0,0001 | 22,9 | 0,224 |
| Sorafenib | Placebo | 5,5 | <0,01 | NR | NA |
| Everolimus | Placebo | 4,0 | <0,0001 | NR | NA |
| Axitinib | Sorafenib | 8,3 | <0,0001 | 20,1 | 0,3744 |
| Nivolumab | Everolimus | 4,6 | 0,11 | 25,0 | 0,002 |
| Cabozantinib | Everolimus | 7,4 | <0,001 | 21,4 | 0,0003 |
| Lenvatinib&Everolimus | Monotherapie | 12,8 | 0,029 | 25,5 | 0,00647 |
PFS = progression-free survival; OAS = overall survival
Wirkprinzipien
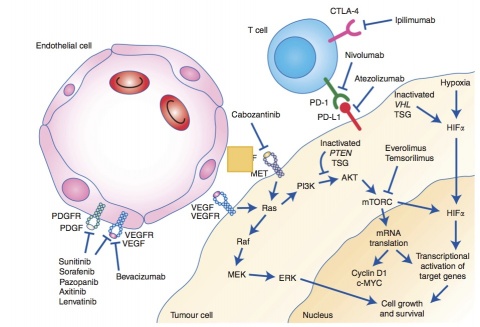
Der VEGF-Antikörper Bevacizumab in Kombination mit IFN bindet an VEGF, so dass eine Aktivierung des VEGF-Rezeptors nicht mehr möglich ist.
Alle erwähnten targeted drugs führen über eine Hemmung der Signaltransduktion in der Tumorzelle zur Hemmung der Neoangiogenese. Durch die Zurückbildung von versorgenden Gefäßen und das Verhindern der Ausbildung neuer Gefäße wird der Tumor mit weniger Sauerstoff versorgt. Es kommt zum Wachstumsstopp oder sogar zum Absterben der Tumorzelle. Abbildung 1 illustriert die verschiedenen Angriffswege der oben beschriebenen Medikamente.
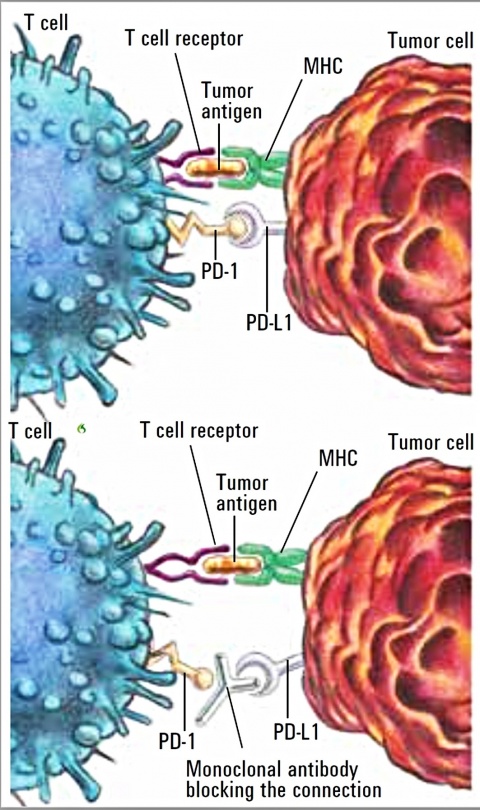
Als sogenannter Checkpoint-Inhibitor bindet Nivolumab an die PD-Rezeptoren (programmed death) auf T-Zellen, so dass die Interaktion mit den Liganden PD-L1 und PD-L2, die von Tumorzellen exprimiert werden und die Tumorzelle sonst vor einer Immunantwort schützen, unterbleibt. Nivolumab führt dementsprechend durch T-Zell-Aktivierung und -Proliferation zu einer Zerstörung der Tumorzellen (Abbildung 2 unten).
Diskussion
Mit der Einführung der zielgerichteten Substanzen (targeted drugs) konnten in den letzten zehn Jahren enorme Fortschritte in der Therapie des mRCC erzielt werden. Zuvor wurden seit 1985 bei diesem nicht chemo-, hormon- oder radiosensiblen Tumor zunächst unspezifische Immuntherapeutika eingesetzt. Zu dieser Gruppe gehören die Zytokine Interferon-⍺ (IFN) und Interleukin-2 [18]. Jedoch profitierten nur Patienten mit einem guten Risikoprofil von der Therapie bei ausgeprägtem Nebenwirkungsspektrum [12].
Auch von der targeted Therapie können nicht alle Patienten in gleicher Weise profitieren. HENG et al. konnten 2009 und 2013 Subgruppen kategorisieren, die sehr unterschiedliche Prognosen aufwiesen, was zur Etablierung des Heng-Scores (IMDC-Risikofaktoren) führte und die Motzer-Kriterien ablöste (Tabelle 2 und 3) [8].
Tab. 2: IMDC-Risikofaktoren (International Metastatic RCC Database Consortium) [8]
| erhöhte LDH (> 1,5-fache der Norm) |
| Hämoglobin unterhalb des Normwertes |
| Thrombozyten oberhalb des Normwertes |
| Neutrophile oberhalb des Normwertes |
| erhöhtes Serum-Calcium |
| schlechter Performance-Status (Karnofsky-Index < 80 %) |
| schnelle Progression (Zeit von Diagnosestellung bis Behandlungsbeginn < 1 Jahr) |
Tab. 3: Risikogruppen nach den IMDC-Risikofaktoren und jeweilige Prognose [8]
| Risikogruppe | Anzahl der Risikofaktoren | medianes Gesamtüberleben |
| niedrig | 0 | 43,2 Monate |
| intermediär | 1-2 | 22,5 Monate |
| hoch | 3-5 | 7,8 Monate |
Insbesondere Patienten der intermediate- und poor risk-Gruppen weisen auch in der TKI-Ära wenig befriedigende Ergebnisse bezogen auf das Gesamtüberleben auf, was in Kenntnis der Zulassungsstudien nur folgerichtig ist; konnte doch lediglich Temsirolimus einen Überlebensvorteil zeigen, und das auch nur bei Patienten der poor risk-Gruppe.
Alle anderen Tyrosinkinaseinhibitoren und Antikörper verbessern zwar das progressionsfreie Überleben, nicht aber das Gesamtüberleben.Zwei im Jahre 2016 neu vorgestellte targeted drugs konnten erstmalig eine Verbesserung des Gesamtüberlebens zeigen, was zur Zulassung von Cabozantinib und Nivolumab in der Zweitlinientherapie geführt hat. Beide Substanzen konnten in der Subgruppenanalyse signifikante Vorteile gegenüber Everolimus auch bei Vorliegen einer Poor-Risk Situation mit ossären oder viszeralen Metastasen zeigen [13]. In einer weiteren Subgruppenanalyse zeigte sich, dass die Vorbehandlung einen signifikanten Einfluss auf die Ergebnisse hatte; Nivolumab nach Pazopanib und Cabozantinib nach Sunitinib erreichten signifikant bessere Ergebnisse als vice versa [13].
Kombinationstherapien
Therapiemonitoring und Nebenwirkungsmanagement
Unter der laufenden Systemtherapie ist eine Verlaufskontrolle zur Erfassung des Tumoransprechens notwendig. Da prospektive Daten zur Untersuchung des optimalen Zeitpunkts der Kontrolluntersuchung nicht bekannt sind, sollte wie in den Zulassungsstudien eine Schnittbildgebung alle sechs bis zwölf Wochen zur Verlaufsbeurteilung erfolgen [10].
Da die Wirkmechanismen der targeted drugs im Vergleich zur klassischen Chemotherapie völlig unterschiedlich sind, wird der behandelnde Arzt durch das Auftreten typischer Nebenwirkungen vor neue Herausforderungen gestellt (Tabelle 4). Diese Nebenwirkungen müssen zeitnah als solche erkannt und die Patienten einer onkologisch versierten Einrichtung, bei Soldatenpatienten i. d. R. der behandelnden urologischen Fachabteilung eines BwKrhs, zugeführt werden. Bei leichten bis moderaten Nebenwirkungen ist eine symptomatische Therapie zumeist ausreichend; bei schweren Nebenwirkungen kommen Therapieunterbrechung, Dosisreduktion oder eine Modifikation des Verordnungsschemas in Betracht.
Tab. 4: Die 5 häufigsten Nebenwirkungen der targeted drugs (gem. jeweiliger Arzneimittelinformation)
| Wirkstoff/-kombination | Häufigste Nebenwirkungen | ||||
| Sorafenib | Diarrhoe | Rash | Fatigue | Hand-Fuß-Syndrom | Alopezie |
| Sunitinib | Diarrhoe | Fatigue | Nausea | Stomatitis | Hypertonie |
| Bevcizumab + Interferon α-2A | Pyrexie | Anorexie | Fatigue | Blutungen | Asthenie |
| Temsirolimus | Asthenie | Rash | Anämie | Nausea | Anorexie |
| Everolimus | Stomatitis | Rash | Fatigue | Asthenie | Diarrhoe |
| Pazopanib | Diarrhoe | Hypertonie | Haarfarben-veränderung | Nausea | Anorexie |
| Axitinib | Diarrhoe | Hypertonie | Fatigue | Anorexie | Nausea |
| Nivolumab | Fatigue | Nausea | Pruritus (immunvermittelt) | Diarrhoe (immunvermittelt) | Anorexie |
| Cabozantinib | Diarrhoe | Fatigue | Nausea | Anorexie | Hand-Fuß-Syndrom |
| Lenvatinib + Everolimus | Diarrhoe | Fatigue | Hypertonie | Nausea | Tussis |
Fazit
Dank der Weiterentwicklung von unspezifischen hin zu zielgerichteten Therapeutika hat die medikamentöse Therapie des metastasierten Nierenzellkarzinoms in den letzten 10 Jahren zu einer Verbesserung der Lebensqualität sowie des progressionsfreien und, seit der Entwicklung und Einführung neuer Substanzen, auch des Gesamtüberlebens der betroffenen Patienten geführt.
Neben der aktuellen deutschen S3-Leitlinie zur Diagnostik, Therapie und Nachsorge des Nierenzellkarzinoms (Stand September 2015, redaktionell überarbeitet im April 2017) existieren mit den von der EAU und der ESMO 2016 aktualisierten Guidelines, 3 gleichwertige, nur in wenigen Details voneinander abweichende Leitlinien (Abbildung 4).
Kernaussagen
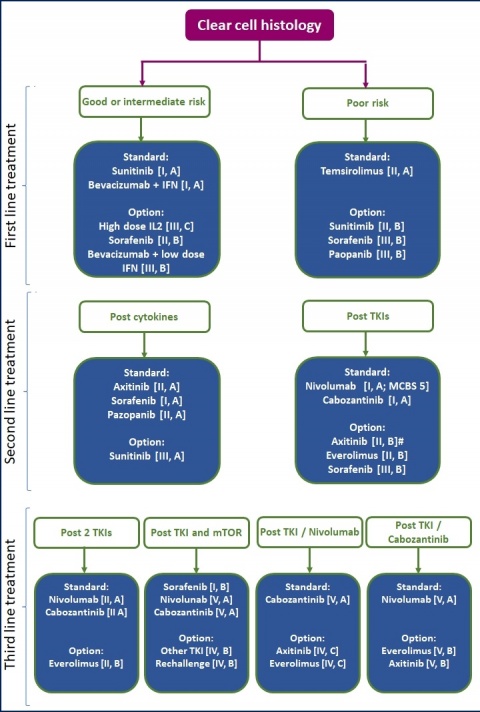
- Die medikamentöse Sequenztherapie des metastasierten Nierenzellkarzinoms basiert auf der Einschätzung des Prognoserisikos.
- Zur Auswahl stehen in der „first line“ die Tyrosinkinaseinhibitoren Sunitinib und Pazopanib sowie Bevacizumab in Kombination mit Interferon-⍺. Bei poor risk-Situation ist eine Therapie mit Temsirolimus, optional mit Sunitinib oder Pazopanib angezeigt.
- In der „second line“ kommen der Checkpoint-Inhibitor Nivolumab oder der Tyrosinkinaseinhibitor Cabozantinib zum Einsatz. Optional stehen weitere Tyrosinkinaseinhibitoren (Axitinib, Sorafenib) zur Verfügung.
- Mit den neu eingeführten Substanzen Cabozantinib und Nivolumab stehen erstmalig Medikamente zur Verfügung, die einen Vorteil für das Gesamtüberleben gezeigt haben.
- Durch die ständige Weiterentwicklung der medikamentösen Therapie entstehen regelmäßig neue Leitlinien und Therapiehinweise, die in das Behandlungskonzept einbezogen werden sollten.
Literatur
Athar U, Gentile TC: Treatment options for metastatic renal cell carcinoma: a review. The Canadian Journal of Urology 2008; 15(2): 3954 - 3966.
Choueiri TK et al.: Cabozantinib versus everolimus in advanced renal cell carcinoma (METEOR): final results from a randomised, open- label, phase 3 trial. Lancet Oncology 2016; 17: 917 - 927.
Escudier B et al.: Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell carcinoma: a randomised, double-blind phase III trial. Lancet Oncology 2007; 370: 2103 - 2111.
Escudier B et al.: Renal cell carinoma: ESMO clinical practice guidelines for diagnosis, teatment and follow-up. Annals of Oncology 2016; 27(5): 58 - 68.
Escudier B et al.: Sorafenib in advanced clear-cell renal-cell carcinoma. New England Journal of Medicine 2007; 356(2): 125 - 134.
Greef B, Eisen T: Medical treatment of renal cancer: new horizons. British Journal of Cancer 2016; 115: 505 - 516.
Gupta K, Miller JD, Li JZ, Russell MW, Charboneau C: Epidemiologic and socioeconomic burden of metastatic renal cell carcinoma (mRCC): a literature review. Cancer Treat Rev 2008; 34(3): 193 - 205.
Heng DY et al.: External validation and comparison with other models of the international metastatic renal-cell carcinoma database consortium prognostic model: a population-based study. Lancet Oncology 2013; 14(2): 141 - 148.
Hudges G et al.: Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. The New England Journal of Medicine 2007; 356(22): 2271 - 2281.
Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Diagnostik, Therapie und Nachsorge des Nierenzellkarzinoms, Langversion 1.2, 2017, AWMF Registernummer: 043/017OL, http://leitlinienprogrammonkologie.de/Nierenzellkarzinom.85.0.html (last accessed on 24 July 2017).
Ljungberg B, Albiges L, Bex A et al.: Guidelines on renal cell carcinoma. European Association of Urology 2016; https://uroweb.org/guidline/renal-cell-carcinoma (last accessed on 24 July 2017).
Motzer RJ et al.: Axitinib versus sorafenib as second-line treatment for advanced renal cell carcinoma: overall survival analysis and updated results from a randomised phase 3 trial. Lancet Oncology 2013; 14(6): 552 - 562.
Motzer RJ et al.: Lenvatinib, everolimus, and the combination in patients with metastatic renal cell carcinoma: a randomised, phase 2, open-label, multicentre trial. Lancet Oncology 2015; 16: 473 - 482.
Motzer RJ et al.: Nivolumab versus everolimus in advanced renal-cell carcinoma. The New England Journal of Medicine 2015; 373: 1803 - 1813.
Motzer RJ et al.: Phase 3 trial of everolimus for metastatic renal cell carcinoma: final results and analysis of prognostic factors. Cancer 2010; 116(18): 4256 - 4265.
Motzer RJ et al.: Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. New England Journal of Medicine 2007; 356(2): 115 - 124.
Postow MA et al.: Immune checkpoint blockade in cancer therapy. Journal of Clinical Oncology 2015; 33(17): 1974 - 1982.
Rosenberg SA et al: Prospective randomized trial of high-dose interleukin-2 alone or in conjunction with lymphokine-activated killer cells for the treatment of patients with advanced cancer. Journal of the National Cancer Institute 1993; 85(8): 622 - 632.
Society for immunotherapy of cancer: Patient resource: Understanding Cancer Immunotherapy. Patient Ressource 2015; 2nd Edition: 4.
Sternberg CN et al.: Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. Journal of Clinical Oncology 2010; 28(6): 1061 - 1068.
Zarrabi K et al.: New treatment options for metastatic renal cell carconoma with prior anti-angiogenesis therapy. Journal of Hematology & Oncology 2017; 10: 38.
Zentrum für Krebsregisterdaten im Robert Koch-Institut: Bericht zum Krebsgeschehen in Deutschland 2016. http://www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebsgeschehen/Krebsgeschehen_node.html (last accessed on 19 June 2017)
Interessenkonflikt:
Frau Dr. Biermann erhielt 2016 von der Firma Novartis ein Honorar für die Teilnahme an einem Advisory Board.
Zitierweise:
Biermann J, Höchel S, Heidenreich H: Medikamentöse Therapie des metastasierten Nierenzellkarzinoms (mRCC) – Update 2017. Wehrmedizinische Monatsschrift 2017; 61(7): 196 - 200.
Citation:
Biermann J, Höchel S, Heidenreich H: Medical treatment of metastatic renal cell carcinoma (mRCC) – Update 2017. Wehrmedizinische Monatsschrift 2017; 61(7): 196 - 200.
Für die Verfasser:
Oberstabsarzt Dr. Juliane Biermann
Bundeswehrkrankenhaus Berlin
Abteilung XI Urologie
Scharnhorststr. 13, 10115 Berlin
julianebiermann@bundeswehr.org
There is an english version of this article under:
http://wehrmed.de/article/3246-pharmacotherapy-of-metastatic-renal-cell-carcinoma-mrcc-2017-update.html
Datum: 23.08.2017
Quelle: Wehrmedizinische Monatsschrift 2017/8