CT-basierte Evaluation der Aortenklappenanatomie vor interventionellem Aortenklappenersatz: Semi-automatische Rekonstruktionsalgorithmen im Vergleich zur manuellen Rekonstruktion
Aus den Abteilungen Radiologie¹ (Ärztlicher Direktor: Oberstarzt Dr. S. Waldeck) und Innere Medizin² (Ärztlicher Direktor: Oberstarzt Prof. Dr. C. Bickel) des Bundeswehrzentralkrankenhauses Koblenz (Chefarzt: Generalarzt Dr. J. Brandenstein) in Kooperation mit dem Institut für Radiobiologie der Bundeswehr (Leiter: Oberstarzt Priv.-Doz. Dr. M. Port) in Verbindung mit der Universität Ulm³, München, dem Institut für Radiologie der Medizinischen Hochschule Hannover⁴ (Institutsdirektor: Prof. Dr. F. Wacker) und dem Zentralen Institut des Sanitätsdienstes der Bundeswehr⁵, Koblenz (Leiter: Prof. Dr. Dr. D. Leyk).
Hintergrund: Für einen erfolgreichen interventionellen Aortenklappenersatz (TAVI) ohne das Auftreten post-interventioneller Komplikationen ist die akkurate Anpassung der Prothese an die individuelle Anatomie entscheidend. Hierfür ist es notwendig, die benötigten Parameter, wie den Aortenklappenanulusdiameter und die Abstände zu den Koronararterien, genau zu bestimmen. Die semi-automatische CT-basierte Messung als reliable und einfache Methode zur Erfassung der benötigten Parameter wurde in dieser Studie untersucht.
Methoden: 52 Patienten erhielten im Rahmen der standardisierten Interventionsvorbereitung ein EKG-getriggertes Mehrschicht-CT zur Evaluation der Aortenklappenebene und wurden zusätzlich echokardiographisch untersucht. Die CT-Datensätze wurden mittels digitaler 3D-Rekonstruktionssoftware rekonstruiert und manuell evaluiert. Retrospektiv führten wir eine Reevaluation der CT-Datensätze mittels Vital™Vitrea®fX Advanced 6.2 TAVR, einem semi-automatischem 3D-Rokonstruktionsprogramm, durch.
Die hier individuell ermittelten Ergebnisse wurden mit der manuellen CT-Messung, der echokardiographischen Untersuchung und den peri-interventionellen Ergebnissen verglichen.
Ergebnisse: Der Durchmesser der Aortenklappenanulusebene wurde in den manuellen CT-Messungen im Vergleich zu den semi-automatischen signifikant überschätzt. Im Mittel differierten die gemessenen Ergebnisse der manuellen Messung um > 4 mm und die der semi-automatischen Messung um < 1 mm zu den echokardiographischen Resultaten. Die Übereinstimmung zwischen letztendlich implantierter Prothesengröße und den Ergebnissen der semi-automatischen Messungen war zudem erhöht.
Diskussion: Obwohl die CT, methodisch bedingt, eine geringere Interobservervariabilität als die Echokardiographie bietet, zeigt diese Studie die Fehleranfälligkeit der manuellen Rekonstruktion. Die ungenaue Identifikation der korrekten Klappenebene erscheint als wahrscheinlichste Ursache für die systematischen Messungenauigkeiten. Die software-gestützte, semi-automatische Methode ermöglicht eine vereinfachte multiplanare Identifikation der korrekten Ebene. Hieraus resultiert eine signifikante Reduktion der Messungenauigkeiten durch die semi-automatische Rekonstruktion.
Schlussfolgerung: Die CT-gestützte Evaluation der Aortenklappenanulusebene mittels modernem semi-automatischem Rekonstruktionsalgorithmus unterstützt die akkuratere Bestimmung der Anatomie vor TAVI ermöglichen. Die Verwendung neuer Rekonstruktionsalgorithmen könnte zudem auch in Bezug auf die Beurteilung komplexer traumatischer Gefäßverletzungen von Interesse sein und sollte weiter untersucht werden.
Schlüsselwörter: TAVI, Computertomographie, semi-automatische Messung, Aortenklappenanulus, Vital™Vitrea®fX Advanced
Einleitung
Die Aortenklappenstenose stellt bei den über 65-jährigen Patienten das häufigste erworbene Vitium dar [1]. Symptomatische Ausprägungen gehen mit einer hohen Mortalität (> 50% innerhalb 2 Jahren) einher. Bis zu 33% der therapiebedürftigen Patienten kommen durch Multimorbidität bzw. Komorbiditäten nicht für einen konventionellen Eingriff in Betracht [2]. Seit der ersten erfolgreichen interventionellen Implantation einer Aortenklappenprothese (TAVI) 2002 durch CRIBIER et al. steigt die Zahl der implantierten Prothesen stetig an [3,4]. Vorrangegangene Studien konnten bereits zeigen, dass das klinische Resultat nach TAVI auf gleichem Niveau mit einem konventionellen Eingriff liegen kann [5,6]. Die stetige Entwicklung neuer Prothesensysteme und modernerer Interventionstechniken könnten das klinische Resultat weiter verbessern. Momentan verschiebt sich die Indikationsstellung zu einem jüngeren Patientenkollektiv und entfernt sich somit zunehmend von dem originären palliativen Ansatz [4]. Dennoch erscheint TAVI weiterhin mit verschiedensten Komplikationen vergesellschaftet. Ein post-interventionelles paravalvuläres Leck ist eine häufige Komplikation, die in manchen Fällen auch hämodynamisch relevant werden kann und den Erfolg der Therapie gefährdet [7,8]. Dies wird in der Literatur - neben anderen Faktoren wie Verkalkungsgrad der Klappentaschen - auch mit nicht optimaler Wahl der Prothesengröße im Rahmen der interindividuellen Variabilität in Verbindung gebracht [9]. Bis zu 30 % der Patienten werden nach der Intervention durch neu aufgetretene höhergradige AV-Blöcke schrittmacherpflichtig [10]. Dies hängt vermutlich mit einer direkten mechanischen Irritation der Faszikel bei der Klappenpositionierung zusammen [11]. BLEIZIFFER et al. konnten zeigen, dass die Entscheidung für eine grenzwertig größere Klappenprothese signifikant mit dem Auftreten post-interventioneller Rhythmusstörungen und konsekutiver Schrittmacherimplantationen einhergeht [12]. Hieraus resultiert die Notwendigkeit, die individuelle Klappenanulusgröße prä-interventionell bestimmen und somit die optimale Prothesenwahl treffen zu können. Momentan erfolgt die Prothesenwahl überwiegend anhand 2D- und 3D-echokardiographischer Verfahren [13,14] sowie nach Auswertung von Datensätzen aus der Mehrschicht-Computertomographie (MSCT) [15]. Im Rahmen der schnell fortschreitenden technischen Entwicklung gelingt es bereits prospektiv gegatete „one-shot“ Volumen-CTs des Herzens während eines einzigen Herzzyklus zu akquirieren, in der die Aortenklappenanulusebene optimal erfasst wird [16]. Die Auswertung der CT-Datensätze erfolgte bis vor ca. 2-3 Jahren mit kommerziell erhältlicher 3D-Rekonstruktionssoftware. Seither veröffentlichte Software zur Auswertung eines TAVI-Planungs-CT verspricht eine halbautomatische Identifikation der Klappenebene mit vereinfachter Auswertung und findet zunehmend den Weg in die Routine.
In der hier vorliegenden Studie wurden retrospektiv CT-Datensätze mittels der halbautomatischen Rekonstruktionssoftware Vital™Vitrea®fX Advanced 6.2 TAVR (Vital Images Inc.™, Minnetonka, MN, USA) nachberechnet. Die Ergebnisse wurden mit den ursprünglichen, manuell nachberechneten CT-Ergebnissen sowie mit den echokardiographisch ermittelten Daten verglichen. Letztendlich wurden die ermittelten Parameter der unterschiedlichen Untersuchungen mit den jeweils interventionell implantierten Prothesentypen verglichen. Ziel der Studie ist es, vor dem Hintergrund der Relevanz der optimalen Prothesenwahl für das klinische Resultat insgesamt und unter der Prämisse eines möglichen Vorteils der halbautomatischen Software gegenüber der manuellen Rekonstruktion, Unterschiede in den Evaluationsmethoden zu detektieren und zu quantifizieren.
Methoden
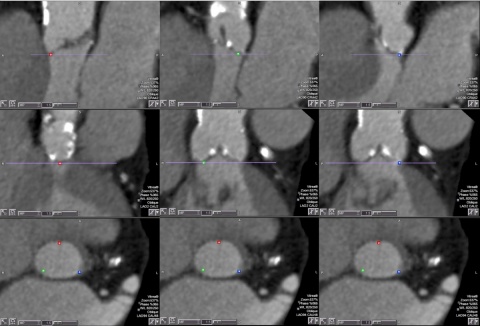
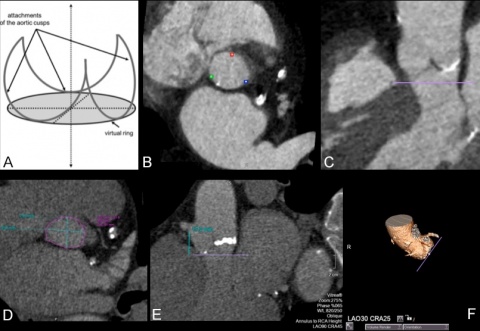
Statistik
McNemar's test wurde zum Vergleich der dichotomen Übereinstimmungshäufigkeiten zwischen CT-morphologisch ermittelter Klappengröße sowie den implantierten Aortenklappenprothesen genutzt. Die sich aus der manuellen und der semi-automatischen CT-Auswertung ergebenden Messdifferenzen der Koronararterien zur Klappenebene sowie die CT-Messdifferenzen der Aortenklappenanulusdiameter wurden mittels Wilcoxon signed-rank test analysiert. Der Messmethodenvergleich zur Evaluation der Aortenklappenanulusdiameter wurde mittels Bland–Altman plot visualisiert. Neben der NYHA Klassifikation (Median) sind die kontinuierlichen Variablen als Mittelwert ± Standardabweichung angegeben. P < 0,05 wurde als statistisch signifikant bei allen Tests festgelegt. SPSS® 20 (IBM, Armonk, NY) wurde für alle statistischen Analysen verwendet.
Ergebnisse
Patientenkollektiv
52 Patienten wurden konsekutiv für eine TAVI evaluiert und erhielten eine prä-interventionelle CT-Bildgebung. Die Patienten waren zum Untersuchungszeitpunkt im Mittel 77,7 Jahre (61 bis 90 Jahre) alt. Das untersuchte Kollektiv imponierte mit einer hohen Morbidität (individueller EuroScore > 20 %). Die Patienten waren größtenteils bereits symptomatisch (NYHA Klasse 2,9 ± 0,45) und es fanden sich echokardiographisch Zeichen einer Aortenklappenstenose (mittlerer Gradient über der Klappe 52,0 ± 15,9 mmHg). 38 Patienten wurden letztlich für eine TAVI ausgewählt und durchliefen die Implantation.
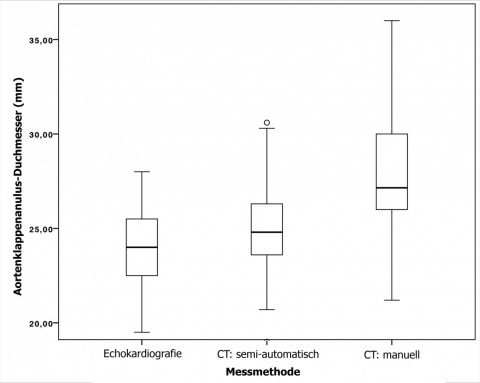
In den untersuchten Messmethoden zeigten sich differierende Ergebnisse bzgl. des mittleren Aortenklappenanulusdiameters (Abb. 3). In der Echokardiographie wurden die kleinsten Diameter ermittelt (24,05 ± 2,27 mm). Die CT-basierte, semi-automatisch retrospektiv gemessenen Diameter waren geringfügig größer (25,03 ± 2,79 mm). Größere Diameter für die Aortenklappenanulusebene (28,53 ± 4,64 mm) wurden mit der manuellen CT-Messung bestimmt.
Methodenvergleich
Manuelle und semi-automatische CT-Auswertung
Die ermittelte Aortenanulusfläche bzw. der Aortenanulusdiameter zeigten eine signifikante Differenz zwischen manueller und semi-automatischer Messung (p < 0,001). Der gemessene mittlere Diameter unterschied sich im Mittel um > 3,5 mm (manuelle Messung: 28,53 ± 4,64 mm; semi-automatische Messung: 25,03 ± 2,79 mm). Bei über 84% (n = 44) der Patienten wurde anhand der semi-automatischen Messmethode ein kleinerer Aortenklappenanulusdiameter im Vergleich zur manuelle Messung ermittelt (Abb. 3 und 4). Der Abstand der linken Koronararterie zur Klappenebene differierte nicht relevant (manuelle Messung: 13,68 ± 3,12 mm; semi-automatische Messung: 13,79 ± 3,03 mm; p = 0,75). Mittels semi-automatischer Messmethode wurde jedoch ein signifikant größerer Abstand der Aortenklappenanulusebene zum Ostium der rechten Koronararterie ermittelt (Manuelle Messung: 14,29 ± 4,21 mm; semi-automatische Messung: 15,63 mm ± 4,10; p = 0,026).
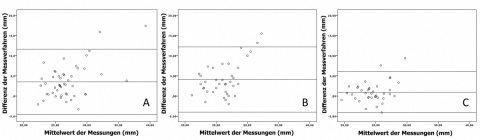
Im Vergleich der semi-automatischen bzw. manuellen CT-Messungen zu den prä-interventionell vorgenommenen echokardiographischen Messungen findet sich ein deutlich divergierendes Ergebnis: Im Mittel beträgt die Differenz der semi-automatisch durchgeführten Messung nur < 1 mm (echokardiografische Messung: 24,05 ± 2,27 mm; semi-automatische CT-Messung: 25,03 ± 2,79 mm), wohingegen die Differenz zwischen den ad primum CT-morphologisch ermittelten Klappendiametern und den echokardiographischen Ergebnissen > 4 mm (echokardiografische Messung: 24,05 ± 2,27 mm; manuelle CT-Messung: 28,53 ± 4,64 mm) beträgt (Abbildungen 3 und 4).
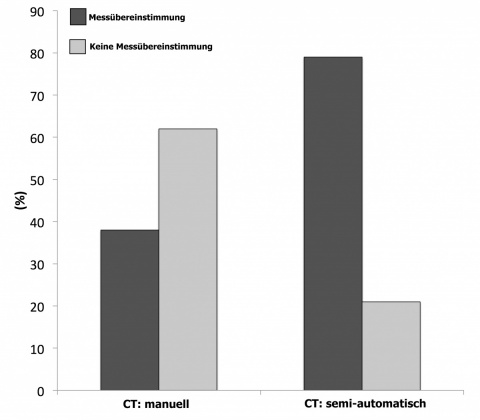
CT und implantierte Prothese
Diskussion
Vor- und Nachteile der unterschiedlichen Methoden
Obwohl es keinen Goldstandard zur Evaluation des Aortenanulusdiameters gibt, wird in der Literatur üblicherweise die transösophageale Echokardiografie bevorzugt [13,14]. Dennoch ist die CT die untersucherunabhängigere Methode, die in der Theorie mindestens gleichwertige Ergebnisse verspricht. Anatomische Parameter, wie Gefäßkinking und arterielle Kalklast, können hierbei in einer Untersuchung gleichzeitig bestimmt werden [15]. Unter Kenntnis dieser Tatsachen erscheint eine verlässlichere Auswertung der Prä-TAVI-CTs von besonderem Interesse für eine optimale Prothesenwahl und einen komplikationsarmen Verlauf.
Die manuelle Angulation der Klappenebene mit exakter Positionierung auf die Ansätze der Aortenklappentaschen erscheint in der vorliegenden Studie jedoch - trotz der technischen Vorteile - fehleranfällig. Die nicht korrekt ausgewählte Ebene ist als Fehlerquelle der, systematisch zu groß ermittelten Aortenklappendurchmessern mittels manueller Messung am wahrscheinlichsten. Die überschätzten Aortenklappenanulusdiameter würden konsekutiv zu einer Implantation von übergroßen Prothesen führen. Dies bedeutet, neben einem erhöhten Risiko für eine schlimmstenfalls auftretende Perforation, besonders eine Risikoerhöhung für eine mechanische Irritation der Faszikel und das konsekutive Auftreten eines höhergradigen AV-Blocks [11,12].
Die semi-automatische Messmethode erleichtert die multiplanar korrigierte Ebenenauswahl erheblich und ermöglicht so die exakte Positionierung durch die vorgegebenen systematischen Arbeitsschritte. Dies spiegelt sich in der deutlich verringerten Streuungsbreite der semi-automatischen Messungen wider. In einer kürzlich veröffentlichten Studie demonstrierten van LINDEN et al. eine nahezu vollständig automatisierte Auswertung mit einer weiteren kommerziellen Softwarelösung (Syngo® AorticValveGuide®, Siemens Healthcare, Forchheim, Germany). Sie konnten hier reliable Ergebnisse im Vergleich mit einer weiteren semi-automatischen Messmethode (3mensio® Medical Imaging BV, the Netherlands) zeigen [19].
Obwohl auch die Abstände der Koronarostien zur Aortenklappenanulusebene teilweise signifikant innerhalb der CT-Messmethoden differieren, hatte dies keinen Einfluss auf die Prothesenwahl, da die Abstände bei beiden Messmethoden innerhalb der vom Hersteller empfohlenen Parameter blieben. Auffallend ist die signifikante Messdifferenz des Abstands zur rechten Koronararterie im Gegensatz zu ähnlich ermittelten Messwerten des Abstands zur linken Koronararterie. Die divergierenden Distanzmessungen zur rechten Koronararterie basieren am ehesten auf rechts-koronar betont falsch positionierter Aortenklappenanulusebene sowie erfahrungsgemäß schwieriger Darstellung dieses Ostiums im Seitenvergleich. Peri-interventionell kam es im Kollektiv zu keiner hämodynamisch relevanten Verlegung der Ostien.
Subjektiv gelang mit der semi-automatischen Messmethode eine Reduktion des Zeitaufwandes zur kompletten Rekonstruktion und Ausmessung der Prä-TAVI-Planungs-CTs. Dies könnte eine bessere Implementierung dieser Spezialmethode in den klinischen Alltag ermöglichen.
Nur in wenigen Fällen, in denen die Bildqualität suboptimal oder die Kontrastphase nicht optimal war, war es nötig die automatische Messung manuell zu korrigieren. Dies deckt sich mit den kürzlich von LOU et al. veröffentlichten Ergebnissen [20]. Insgesamt ergibt sich hieraus die Frage, ob neue Softwarelösungen und modernere Scannersysteme mit schnelleren Akquisitionszeiten und iterativer Rekonstruktion noch verlässlichere Resultate generieren könnten.
Die im semi-automatischen Verfahren ermittelten Werte korrespondierten gut mit den echokardiographischen Messwerten. Auch die erfolgreich implantierten Klappengrößen waren retrospektiv durch die semi-automatische Messung deutlich verlässlicher vorhersagbar. Der Vergleich zwischen echokardiographischer und CT-basierter, semi-automatischer Messung der Aortenanulusdiametern weist nur eine durchschnittliche Differenz von etwa 0,1 cm auf. Unter Beachtung des bekannten systematischen Messfehlers der Echokardiografie - mit unterschätztem Diameter von durchschnittlich 0,1 cm - relativiert sich diese Differenz nahezu vollständig [21]. WATANABE et al. beschrieben kürzlich ähnliche Ergebnisse in der Untersuchung einer weiteren automatischen, kommerziellen Auswertesoftware (3mensio®, Medical Imaging BV, the Netherlands). Sie zeigten zudem, dass post-interventionelle paravalvuläre Lecks bei der Implantation von selbst-expandierenden Klappenprothesen hierdurch besser vorhersagbar wurden als mittels rein manueller Messung in der CT [22]. Besonders bei erschwerten Untersuchungsbedingungsbedingungen, wie Übergewicht, anatomischen Besonderheiten, Lungenemphysem oder unzureichenden Lagerungsmöglichkeiten der Patienten, können echokardiographische Messungen verfälscht werden [23]. Hier ist ein Vergleich mit CT-morphologisch ermittelten Werten unabdingbar um die korrekte Prothesenwahl treffen zu können. Auch bei guten Untersuchungsbedingungen für die Echokardiografie sollte eine relevante Differenz in den echokardiographischen bzw. CT-morphologischen Messungen eine Reevaluation bedingen. Eine ausschließlich manuelle CT-Messung sollte vermieden werden.
Implikationen für die Prothesenwahl
Die verschiedenen kommerziell verfügbaren Aortenklappenprothesen weisen herstellerabhängig schrittweise Größenunterschiede von etwa 3 mm auf [24]. Bei einem systematischen Messfehler der manuellen Methode von etwa 5 mm, wie in der vorliegenden Studie ermittelt, besteht die Möglichkeit der fälschlichen Wahl einer überdimensionierten Prothese. Insbesondere in Anbetracht der Veränderungen der Indikationsstellung hin zu einem jüngeren Patientenkollektiv sollte eine komplikationsärmere Implantation, bzw. eine Minimierung der mit einer falschen Klappenwahl einhergehenden Komplikationen, wie Rhythmusstörungen oder paravalvulärem Leck, angestrebt werden.
Mögliche Anwendung bei traumatischen Gefäßverletzungen
Die MSCT und die implementierten 3D-Rekonstruktionsalgorithmen sind bereits Standard in der Evaluation von traumatischen Gefäßverletzungen [25]. Auch die CT-Angiografie hat sich in der Untersuchung von Gefäßtraumata bei Soldaten bereits bewährt [26]. Besonders im Hinblick auf die Detektion von okkulten Gefäßverletzungen bei Gefechtsverletzungen, wie z.B. “blast-injuries”, ist sie unverzichtbar [27]. Neue automatisierte Rekonstruktionsverfahren könnten hierbei eine schnellere und genauere Evaluation von traumatischen sowie gefechtsassoziierten Gefäßverletzungen bieten und sollten diesbezüglich weiter untersucht werden.
Limitierungen
Die Aussagekraft der Studie wird durch mehrere Faktoren eingeschränkt: Neben dem querschnittlichen Design basieren die Beobachtungen auf einer nicht zwangsläufig repräsentativen Stichprobe („single center“), wodurch stochastische Effekte nicht auszuschließen sind. Hieraus ergibt sich die Notwendigkeit der weiteren Betrachtung größerer Stichproben über einen längeren Zeitraum. Besonders durch die hohe Inzidenz von tachykarden Rhythmusstörungen konnte in vielen Fällen keine EKG-getriggerte CT-Untersuchung erfolgen, wodurch die Patienten nicht in die Studie eingeschlossen werden konnten. Hier versprechen moderne Systeme eine höhere Toleranz und langfristig die Möglichkeit Patienten mit Rhythmusstörungen besser untersuchen zu können.
Schlussfolgerungen
In der vorliegenden retrospektiven Studie zeigte die CT-gestützte Messung der Aortenklappenanulusebene mittels semi-automatischer Rekonstruktion, wie z.B. Vital™Vitrea®fX Advanced, deutlich akkuratere Ergebnisse als mittels manueller Messung. Die semi-automatisch ermittelten Ergebnisse stimmten mit den echokardiographischen Daten und den implantierten Klappengrößen besser überein. Die Daten deuten darauf hin, dass die semi-automatische Messmethode eine validere und untersucherunabhängigere Möglichkeit zur Klappenanulusevaluation als die rein manuelle Messung bietet. Insbesondere eine individuelle, multi-modale Evaluation in Kombination mit der Echokardiografie verspricht valide Messergebnisse, wobei auch das Erkennen inter-modaler Messdifferenzen und eine notwendige Reevaluation zur Vermeidung post-interventioneller Komplikationen führen könnte. CT-basierte Rekonstruktionsalgorithmen könnten auch eine Bedeutung in der Diagnose und Beurteilung von gefechtsassoziierten Verletzungen erlangen und sollten diesbezüglich weiter untersucht werden.
Kernaussagen
- Die Computertomografie ist eine etablierte Methode zur prä-interventionellen Evaluation von Patienten mit Indikation für einen kathergestützten Aortenklappenersatz.
- Eine individuelle Anpassung der Aortenklappenprothese ist für ein gutes klinisches Resultat essentiell.
- Ein moderner semi-automatischer Rekonstruktionsalgorithmus für die individuelle Erfassung der anatomischen Interventionsparameter wurde retrospektiv untersucht.
- Die Untersuchung zeigte gute Ergebnisse im Vergleich zur manuellen Messmethode.
- Moderne Rekonstruktionsalgorithmen könnten langfristig auch für eine schnellere und genauere Evaluation von gefechtsassoziierten Gefäßverletzungen vorteilhaft sein.
Literaturverzeichnis
- Vahanian A, Baumgartner H, Bax J, et al.: Guidelines on the management of valvular heart disease: The Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology. Eur Heart J 2007; 28: 230-268.
- Lung B, Cachier A, Baron G, et al.: Decision-making in elderly patients with severe aortic stenosis: why are so many denied surgery? Eur Heart J 2005; 26: 2714-2720.
- Cribier A, Eltchaninoff H, Bash A, et al.: Percutaneous trans- catheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation 2002; 106: 3006-3008.
- Cribier A: Development of transcatheter aortic valve implantation (TAVI): a 20-year odyssey. Arch Cardiovasc Dis 2012; 105(3): 146-152.
- Kodali SK, Williams MR, Smith CR, et al.: For PARTNER Trial Investigators. Two-year outcomes after transcatheter or surgical aortic valve replacement. N Engl J Med 2012; 366: 1686-1695.
- Smith CR, Leon MB, Mack MJ, et al.; Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med 2011; 364: 2187-2198
- Rallidis LS, Moyssakis IE, Ikonomidis I et al.: Natural history of early aortic paraprosthetic regurgitation: a five-year follow-up. Am Heart J 1999; 138: 351-357.
- Sherif MA, Abdel-Wahab M, Stocker B: Anatomic and procedural predictors of paravalvular aortic regurgitation after implantation of the Medtronic CoreValve bioprosthesis. J Am Coll Cardiol 2010; 56: 1623-1629
- Détaint D, Lepage L, Himbert D, et al.: Determinants of significant paravalvular regurgitation after transcatheter aortic valve: implantation impact of device and annulus discongruence. J Am Coll Cardiol Intv 2009; 2: 821-827.
- Eltchaninoff H, Prat A, Gilard M, et al.: Transcatheter aortic valve implantation: early results of the FRANCE (FRench Aortic National CoreValve and Edwards) Registry. Eur Heart J 2011; 32 :191-197.
- Jilaihawi H, Chin D, Vasa-Nicotera M: Predictors for permanent pacemaker requirement after transcatheter aortic valve implantation with the CoreValve bioprosthesis. Am Heart J 2009; 157: 860-866.
- Bleiziffer S, Ruge H, Horer J: Predictors for new-onset complete heart block after transcatheter aortic valve implantation. J Am Coll Cardiol Intv 2010; 3: 524-530.
- Messika-Zeitoun D, Serfaty JM, Brochet E. Multimodal assessment of the aortic annulus diameter: implications for transcatheter aortic valve implantation. J Am Coll Cardiol 2010; 55: 186-194.
- Vahanian A, Alfieri O, Al-Attar N, et al.: Transcatheter valve implantation for patients with aortic stenosis: a position statement from the European Association of Cardio Thoracic Surgery (EACTS) and the European Society of Cardiology (ESC), in collaboration with the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur Heart J 2008; 29: 1463-1470.
- Achenbach S, Delgado V, Hausleiter J, et al.: SCCT expert consensus document on computed tomography imaging before transcatheter aortic valve implantation (TAVI) / transcatheter aortic valve replacement (TAVR). J Cardiovasc Comput Tomogr 2012; 6: 366-380.
- Lehmkuhl L, Foldyna B, Von Aspern K et al.: Inter-individual variance and cardiac cycle dependency of aortic root dimensions and shape as assessed by ECG-gated multi-slice com- puted tomography in patients with severe aortic stenosis prior to transcatheter aortic valve implantation: is it crucial for correct sizing? Int J Cardiovasc Imaging 2013; 29:693-703.
- Holmes DR, Mack MJ, Kaul S, et al.: ACCF/AATS/SCAI/STS expert consensus document on transcatheter aortic valve replacement: developed in collaboration with the American Heart Association, American Society of Echocardiography, European Association for Cardio-Thoracic Surgery, Heart Failure Society of America, Mended Hearts, Society of Cardiovascular Anesthesiologists, Society of Cardiovascular Computed Tomography, and Society for Cardiovascular Magnetic Resonance. Ann Thorac Surg 2012; 93: 1340-1345.
- Gurvitch R, Webb JG, Yuan R, et al.: Aortic annulus diameter determination by multidetector computed tomography: reproducibility, applicability, and implications for transcatheter aortic valve implantation. JACC Cardiovasc Interv 2011; 4: 1235-1245.
- Van Linden A, Kempfert J, Blumenstein J, et al.: Manual versus automatic detection of aortic annulus plane in a computed tomography scan for transcatheter aortic valve implantation screening. Eur J Cardiothorac Surg 2014; 46(2): 207-212.
- Lou J, Obuchowski NA, Krishnaswamy A, et al.: Manual, semiautomated, and fully automated measurement of the aortic annulus for planning of transcatheter aortic valve replacement (TAVR/TAVI): Analysis of interchangeability. J Cardiovasc Comput Tomogr 2014; 14:1934-5925.
- Ng AC, Delgado V, van der Kley F: Comparison of aortic root dimensions and geometries before and after transcatheter aortic valve implantation by 2- and 3-dimensional transesophageal echocardiography and multislice computed tomography. Circ Cardiovasc Imaging 2010; 3: 94-102
- Watanabe Y, Morice MC, Bouvier E, et al.: Automated 3-dimensional aortic annular assessment by multidetector computed tomography in transcatheter aortic valve implantation. JACC Cardiovasc Interv 2013; 9: 955-964.
- Buck T, Breithardt OA, Faber L, et al.: Manual zur Indikation und Durchführung der Echokardiographie. Clin Res Cardiol Supl 2009; 4(1): 3-51.
- Al-Lamee R, Godino C, Colombo A: Transcatheter aortic valve implantation: current principles of patient and technique selection and future perspectives. Circ Cardiovasc Interv 2011; 4: 387-95.
- Anderson SW, Lucey BC, Varghese JC, Soto JA: Sixty-four multi-detector row computed tomography in multitrauma patient imaging: early experience. Current problems in diagnostic radiology 2006; 35(5): 188-198.
- White PW, Gillespie DL, Feurstein I, et al.: Sixty-four slice multidetector computed tomographic angiography in the evaluation of vascular trauma. J Trauma Acute Care Surg 2010; 68(1): 96-102.
- Watchorn J, Miles R, Moore N: The role of CT angiography in military trauma. Clinical radiology 2013; 68(1): 39-46.
Interessenkonflikte:
Alle Autoren erklären, dass keine Interessenskonflikte bestehen.
Zitierweise:
Becker B, Nestler K, von Falck C, Veit D, Joeckel J, Waldeck S: CT-basierte Evaluation der Aortenklappenanatomie vor interventionellem Aortenklappenersatz: Semi-automatische Rekonstruktionsalgorithmen im Vergleich zur manuellen Rekonstruktion. Wehrmedizinische Monatsschrift 2017; 61(4): 74 – 80.
Für die Verfasser:
Oberstabsarzt Dr. Benjamin V. Becker
Institut für Radiobiologie der Bundeswehr
Neuherbergstrasse 11, 80937 München
Email: benjamin3becker@bundeswehr.org
Datum: 17.04.2017
Wehrmedizinische Monatsschrift 2017/4