Molecular Matchmaking
Sonja Sichler*
Einleitung
Der wiederholte Einsatz von Sarin im syrischen Bürgerkrieg sowie die hohe jährliche Inzidenz von Vergiftungen mit phosphororganischen Pestiziden belegen, dass auch heute noch eine ernstzunehmende Gefahr von phosphor-organischen Verbindungen bzw. Organophosphaten gegen Militär und Zivilbevölkerung ausgeht. Im Vergiftungsfall bedarf es einer raschen und vor allem effektiven Therapie.
Grenzen der bisherigen Therapie
Organophosphate inaktivieren das Enzym Acetylcholinesterase (AChE), wodurch sich der Neurotransmitter Acetylcholin im synaptischen Spalt anhäuft und dauerhaft muskarinische wie nikotinische Acetylcholinrezeptoren (mAChRs bzw. nAChRs) aktiviert. Die Überreizung die-ser Rezeptoren ist ursächlich für die Symptome einer Organophosphat (OP)-Vergiftung, darunter Miosis, Bronchokonstriktion und Muskelkrämpfe, die in schweren Fällen zum Tod durch Atemlähmung führen. Die Pharmakotherapie von OP-Vergiftungen beinhaltet die Gabe eines Oxims, wie z. B. Obidoxim bzw. Pralidoxim, sowie von Atropin als Antidot. Letzteres wirkt als Antagonist der Überstimulation muskarinischer Acetylcholinrezeptoren entgegen. Des Weiteren wird ein Oxim zur Reaktivierung der AChE verabreicht. Die Wiederherstellung der Enzymfunktion ist allerdings – abhängig von der Struktur des Organophosphats sowie von der Zeit, welche zwischen Organophosphat-Aufnahme bis zur medikamentösen Intervention verstrichen ist – nicht in jedem Fall effektiv. In einigen Fällen hält die Überaktivierung des nikotinischen Acetylcholinrezeptors daher an, wobei dieser schließlich in einen nicht-funktionalen, desensitisierten Zustand übergeht, welcher bislang therapeutisch nicht angesteuert werden kann.Neue potenzielle Antidote
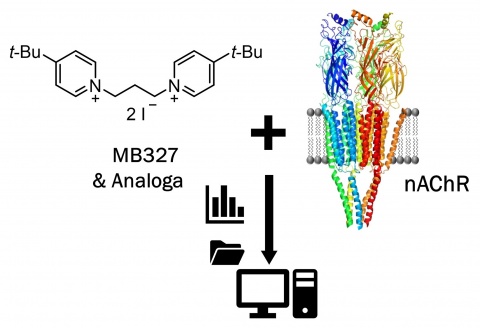
Als sehr vielversprechende Therapieform erscheint des-halb eine direkte pharmakologische Intervention am -desensitisierten nAChR, um diesen wieder in eine funktionale Form zu überführen. In funktionalen Messungen, durchgeführt von Niessen et al. [1], auf einer sogenannten SURFE2R -Plattform 1 indirekte elektrophysiologische Messungen, erwies sich dieses bereits als möglich. MB327, eine 4-tert-Butyl-substitutierte Bispyridiniumverbindung, zeigte hier die Fähigkeit, den desensitisierten nAChR wiederherzustellen. Der therapeutische Effekt der Bispyridiniumverbindung konnte außerdem bereits in ex-vivo, in-vitro sowie in-vivo Studien demonstriert werden [2, 3]. Da vorangegangene Studien zeigten, dass MB327 nur schwach an die orthosterische, d. h. Agonisten-Bin-dungsstelle, bindet, scheint dessen funktionelle Aktivität über eine allosterische Modulation am nAChR vermittelt zu werden. Im Rahmen eines kooperativen Forschungs-projekts (Abbildung 1 und 2) einer Forschungsgruppe um Prof. Dr. Klaus T. Wanner, Lehrstuhl für pharmazeutische Chemie der Ludwig-Maximilians-Universität München, mit der Arbeitsgruppe von Oberfeldapotheker Dr. Karin Niessen, Institut für Pharmakologie und Toxikologie der Bundeswehr -(InstPharmToxBw) in München, gelang es erstmals, die MB327-Bindestelle am nAChR zu charakterisieren.Erfolgreiche Kooperation
Literatur
- Niessen KV et al.: Functional analysis of Torpedo californica nicotinic acetylcholine receptors in multiple activation states by SSM-based electrophysiology. Toxicol. Lett. 2016; 247: 1-10.
- Seeger T. et al.: Restoration of soman-blocked neuromuscular transmission in human and rat muscle by the bispyridinium non-oxime MB327 in vitro. Toxicology 2012; 294: 80-84.
- Timperley CM et al.: 1,1’-(Propane-1,3-diyl)bis(4-tert-butylpyridinium) di(methanesulfonate) protects guinea pigs from soman poisoning when used as part of a combined therapy. Med. Chem. Commun. 2012; 3: 352-356.
- Sichler S et al.: Development of MS Binding Assays targeting the binding site of MB327 at the nicotinic acetylcholine receptor. Toxicology Letters 2018; 293: 172-183.
- Rappenglück S et al.: Synthesis of a Series of Structurally Diverse MB327 Derivatives and Their Affinity Characterization at the Nicotinic Acetylcholine Receptor. ChemMedChem 2018; 13: 1806-1816.
- Rappenglück S et al.: Synthesis of a Series of Non-Symmetric Bispyridinium and Related Compounds and Their Affinity Characterization at the Nicotinic Acetylcholine Receptor. ChemMedChem 2018; 13: 2653-2663.
Der Beitrag belegte den 1. Platz im Science Slam-Wettbewerb.
Für die Verfasser
Major (res.) Dr. Sonja Sichler, M. Sc.
E-Mail: sonjasichler@bundeswehr.org
1 SURFE2R = Surface Electrogenic Event Reader
*Institut für Pharmakologie und Toxikologie der Bundeswehr, München
Datum: 30.09.2019